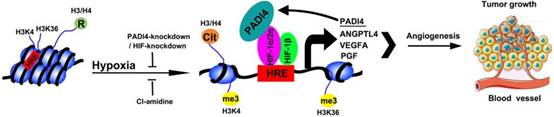
癌细胞的快速增殖加上肿瘤血管的结构和功能异常,导致实体瘤内的区域氧气供应减少,形成缺氧微环境。研究证实缺氧与肿瘤高侵袭性特征、治疗抵抗以及临床预后不良密切相关。在缺氧条件下,缺氧诱导因子α(HIFα)的羟基化和泛素蛋白酶体降解减弱,因此HIFα稳定并转移到细胞核中,其与HIFβ形成异二聚体复合物,进而结合靶基因启动子中的缺氧反应元件(HREs)激活转录。HIFs是癌细胞适应缺氧环境最重要的内源性转录因子,可调节涉及增殖、葡萄糖代谢、血管生成、肿瘤侵袭和耐药的多种基因。因此,HIFs可以说是肿瘤中最有吸引力的药物靶标之一,进一步深入研究HIFs涉及的调控机制,有助于开发特异性靶向HIFs的肿瘤治疗新策略。
近日,西安交通大学第一附属医院肝胆外科刘青光教授研究团队和2019年诺贝尔生理学或医学奖获得者、美国科学院院士、美国医学院院士、美国艺术与科学院院士、美国约翰霍普金斯大学医学院Gregg L. Semenza教授研究团队共同合作,创新性地发现在乳腺癌和肝癌细胞中肽基精氨酸脱亚胺酶4(PADI4)以HIF依赖性方式由缺氧诱导表达,PADI4反过来被HIFs募集到HREs,从而参与HIF靶基因转录。缺氧通过PADI4和HIF依赖性方式在HREs处诱导组蛋白瓜氨酸化,RNA测序显示乳腺癌细胞中几乎所有HIF靶基因表达都依赖于PADI4。另外,PADI4是小鼠乳腺和肝脏肿瘤生长和血管生成所必需的。PADI4表达与人乳腺癌组织中HIF-1α表达和血管生成相关。该研究表明靶向HIF和/或PADI4活性的小分子抑制剂研发可能是乳腺癌和肝癌患者的一种新治疗策略。
该研究成果近期发表在国际著名综合性期刊《科学进展》(Science Advances),最新影响因子14.132。论文题目为“PADI4对组蛋白瓜氨酸化是缺氧的HIF依赖性转录反应和肿瘤血管化所必需的(Histone citrullination by PADI4 is required for HIF-dependent transcriptional responses to hypoxia and tumor vascularization)”。西安交通大学第一附属医院肝胆外科王宇锋博士为文章第一作者,涂康生副研究员为共同第二作者,刘青光教授与Gregg L. Semenza教授为共同通讯作者。近年来,刘青光教授团队致力于肿瘤微环境的基础-临床-转化研究及学科建设,注重研究生临床和科研思维的训练、培养,采取先临床实习后基础研究的培养模式,取得了多项具有临床应用前景的科研成果。
文章相关链接:
https://advances.sciencemag.org/content/7/35/eabe3771
https://pubmed.ncbi.nlm.nih.gov/34452909







