脊椎动物的早期胚胎是辐射对称的球体,随着发育的进行,这种对称性逐渐被打破,胚胎开始获得前后极性,并最终形成一个外观上明显的前后图式:沿着前后轴依次发育形成头、躯干和尾巴。FGF、WNT和RA等几条进化上保守的信号通路控制着脊椎动物早期胚胎的前后图式形成过程,这些信号的激活可促进后部发育,而它们的抑制则促进前部发育。鉴定新的前后图式形成的调控因子对于我们理解这一基本的发育过程具有重要意义。

5月12日,我校医学部基础医学院/转化医学研究院脑科学研究所丁毅课题组联合美国加州大学洛杉矶分校Edward M. De Robertis课题组、清华大学陶庆华课题组在PNAS杂志上发表题为“The Cytokine FAM3B/PANDER is an FGFR Ligand that Promotes Posterior Development in Xenopus”的文章,该研究发现细胞因子FAM3B/PANDER是一个FGF信号的新配体,可在非洲爪蟾早期胚胎中通过激活FGFR/ERK通路促进后部发育。
人FAM3B(Family With Sequence Similarity 3,Member B)基因,也称作PANDER(Pancreatic-Derived Factor,胰腺衍生因子),编码一个功能多样的细胞因子。FAM3B在糖脂代谢过程中发挥重要作用,其功能失调可导致二型糖尿病。此外,FAM3B还可调控多种癌症的发生和发展过程。但是由于相应受体尚未被鉴定出来,FAM3B发挥生物学功能的分子机制仍不明确。
研究人员首先通过RNA-seq筛选发现FAM3B基因可能参与非洲爪蟾胚胎的早期胚胎发育过程。进一步研究发现,在非洲爪蟾胚胎中显微注射fam3b mRNA或者纯化的人FAM3B蛋白都可诱导产生额外的尾巴并抑制头部发育,而FAM3B敲低则促进头部发育。体外结合实验表明纯化的FAM3B蛋白可以直接结合FGFR受体。在哺乳动物细胞中,FAM3B条件培养基可显著激活FGFR下游的ERK激酶,并且ERK的激活可被显性负效应的FGFR1或者多种FGFR小分子抑制剂(SU5402、Erdafitinib、AZD4547和Ly2874455)阻遏。最后,在非洲爪蟾胚胎中,显微注射人FAM3B蛋白诱导产生的额外尾巴和对头部发育的抑制可被显性负效应的FGFR1或者FGFR抑制剂拯救。
总之,该研究鉴定了一个新的FAM3B/FGFR/ERK通路,并证明其在脊椎动物胚胎前后图式形成过程中发挥重要作用。FAM3B很有可能在二型糖尿病和癌症的发生中也通过这一分子机制起作用。目前,FGFR的多种小分子抑制剂已作为抗癌药被批准上市或正在进行临床试验,该研究提示这些FGFR小分子抑制剂也可以作为治疗FAM3B相关的二型糖尿病和癌症的候选药物。
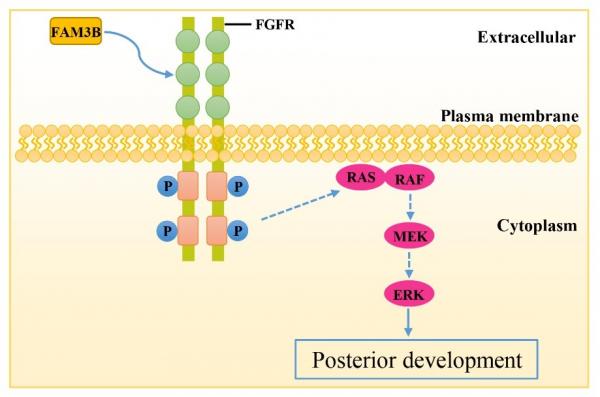
细胞因子FAM3B激活FGFR/ERK通路示意图
西安交通大学医学部基础医学院张芳芳、西湖大学朱薛辰和清华大学汪盼为论文的共同第一作者。陶庆华教授、Edward M. De Robertis教授和丁毅研究员为论文的共同通讯作者。西安交通大学为论文完成的第一单位。基础医学院何青、贾红、许临平,西安儿童医院黄惠梅和西安交通大学口腔医院赵华翔为论文共同作者。该研究得到国家自然科学基金项目和西安交通大学“青年拔尖人才支持计划”的资助。
全文链接:https://www.pnas.org/content/118/20/e2100342118








